1.“生物导弹”开启创新药新时代
1.1.ADC作用机理及发展史
抗体偶联药物由单克隆抗体、连接子和载药三部分构成,ADC通过单克隆抗体特异性地结合肿瘤细胞表面高表达的靶抗原,形成ADC-抗原复合物,然后通过网格蛋白介导的内吞作用进入细胞,使载药进入肿瘤细胞发生药力从而杀死肿瘤细胞。ADC药物兼具抗体的高特异性和细胞素的高抗肿瘤活性,同时因其定向释放的特性,安全性更加可控,是目前肿瘤治疗领域的热点研究方向之一。
自1910年免疫学之父PaulEhrilich提出“魔法子弹”的概念,伴随杂交瘤技术、单克隆抗体技术、重组蛋白质工程技术等的成熟,辉瑞于2000年推出全球首款上市的ADC药物Mylotarg,后因严重副作用陷入撤市风波后整个ADC研发领域不温不火,自2019年以来全球已获批9款ADC药物,整个领域迎来爆发期,至此已历经百年。
1.2.靶抗原、抗体、载药、连接子以及偶联方式是构成ADC的五大要素
开发ADC药物具有较高的技术壁垒,需要综合考虑靶抗原、抗体、载药、连接子以及偶联方式多个因素,具体来说:
1.2.1.靶抗原
靶抗原为ADC识别肿瘤细胞提供了导航方向,是ADC药物开发首先要考虑的因素,具体来说理想的抗原具有以下几个特征:
特异性:靶抗原应仅在或主要在肿瘤细胞中表达,而在正常组织中不表达或表达很少,以降低脱靶性,而且靶抗原应为肿瘤细胞表面抗原而非细胞内抗原,以便被ADC所识别。
非分泌性:分泌的抗原会结合血液循环中的ADC,这样会减少与病灶部位肿瘤结合的ADC,从而导致对肿瘤靶向性降低并增加安全性问题。
可有效内化:ADC药物的抗体识别靶抗原后在受体介导下经细胞本身的内吞作用使ADC-抗原复合物进入肿瘤细胞内部。
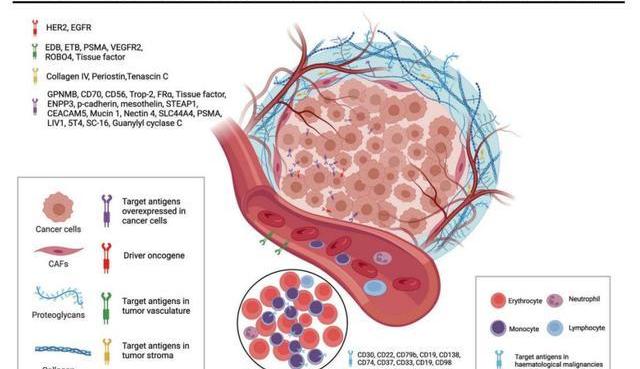
目前获批的ADC药物的靶抗原通常是癌细胞过表达的特异性蛋白,如针对实体瘤的靶点HER2、Trop2、Nectin4和EGFR,针对血液瘤的靶点CD19、CD22、CD33、CD30、BCMA和CD79b。随着肿瘤学和免疫学基础研究的不断深入,ADC靶抗原的选择已逐渐从传统的肿瘤细胞抗原扩展到肿瘤微环境中的靶标。临床前和临床研究的最新证据显示:新生血管系统、内皮下细胞外基质和肿瘤基质的成分可能是ADC药物开发有价值的靶抗原。例如,基质靶向ADC药物有可能通过降低基质驻留细胞产生的生长因子浓度而导致癌细胞死亡。ADC通过靶向癌细胞存活所依赖的血管生成因子和基质因子,可能具有更广泛的功效。而且产生这些因子的细胞的基因组比癌细胞的基因组更为稳定,这可以为降低突变引起的耐药性提供一种有希望的手段。
1.2.2.抗体
抗体承担导航及素载体功能,对于ADC药物的疗效、药代动力学、药效学特征有重要影响。为了降低免疫原性,抗体来源从早期的鼠源性抗体已经过渡到现在的人源化抗体,从抗体类型来看,由于免疫球蛋白G天然结合位点多,对靶抗原亲和力高,血液循环中半衰期较长目前广泛应用于ADC的研发中。IgG有四种亚型,各亚型的结构和功能差异如下:
目前已上市的ADC药物中,除辉瑞的Mylotarg和Besponsa采用IgG4抗体,其余均选择IgG1作为抗体。IgG1和IgG3相比IgG2和IgG4对Fc受体的亲和力更高,表明其可以介导更强的激活抗体依赖的细胞性效应及补体依赖的细胞性效应。IgG3半衰期短,易被清除,IgG2则会形成二聚体诱发聚集导致ADC失效,因而这两种亚型应用较少。
1.2.3.连接子
连接子是抗体与载药之间形成共价连接的部分,是靶向药物治疗中的关键元件,连接子的加入不应诱导聚集,并且需要确保可接受的PK特性,避免过早裂解导致载药对正常细胞造成杀伤作用,但又要使ADC进入肿瘤细胞后有效释放。因而,连接子是决定ADC药物临床疗效和副作用的关键组分,连接子从性能上可分为可裂解连接子和不可裂解连接子。可裂解型的连接子利用体循环和肿瘤细胞之间的环境差异分解并释放载药,可进一步分为化学依赖性连接子和基于肽键的酶依赖性连接子。由于血液中存在蛋白酶抑制剂,酶依赖性连接子在体循环中通常是稳定的,当ADC到达病灶后,酶依赖性连接子被肿瘤细胞中过度表达的溶酶体蛋白酶降解,载药被释放并扩散到临近细胞进一步增强对肿瘤的杀伤力,诱发所谓的“旁杀者效应”。因而,这类连接子被广泛使用在已经批准上市的14款ADC药物中,9款使用基于肽键的酶依赖性连接子,代表性药物如维布妥昔单抗,polatuzumabvedotin,戈沙妥珠单抗,T-DXd等。
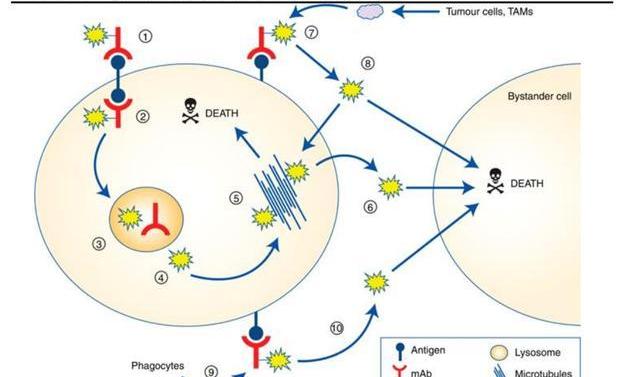
不可裂解连接子是通过细胞内溶酶体切割抗体和连接子的连接,其在血浆中更稳定,因而脱靶性更低,但这种切割方式常导致载药上的带电氨基酸保留从而影响其细胞通透性,阻止载药扩散到周围细胞,因而不会产生“旁杀者效应”。常见的不可裂解连接子如硫醚连接子、酰胺类连接子等,代表性药物如:T-DM1,Belantamabmafodotin。
1.2.4.载药
载药是ADC内化到肿瘤细胞后发挥细胞性的化学分子,通常静脉注射给药只有大约2%的ADC可以到达肿瘤部位,所以一般要求载药的性要足够强,IC50值在0.01-0.1nM,还要具有足够的水溶性及血清中的稳定性,具有与抗体共价结合的功能基团,作用靶点位于细胞内等。目前,常用的ADC载药主要包括强效微管蛋白抑制剂、DNA损伤剂和免疫调节剂。
早期的ADC设计中使用传统化疗药物,例如:甲氨蝶呤、多柔比星、长春新碱等,研究显示这种ADC并不比它们的传统模式更有效。抗体靶向给药剂量中只有很小一部分能够到达肿瘤组织,提示需要具有更强细胞性的载荷才能达到治疗效果。因此,在后续的ADC研究中引入了性更强的化疗药物,例如:Auristatins、calicheamicins、美登素类化合物、喜树碱衍生物等,这些药物在亚纳摩尔级浓度下就可显示出细胞性。除此之外,越来越多的新型载药如Toll样受体激动剂和干扰素基因刺激剂激动剂被引入ADC的设计中,使得ADC的种类越来越丰富。
1.2.5.载药-抗体比
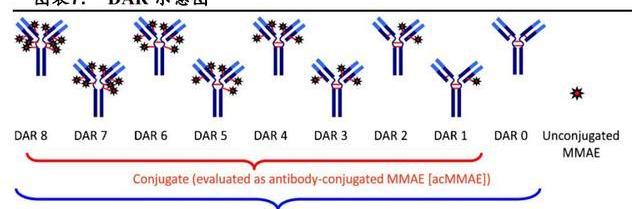
载药-抗体比例,是指每个单抗上搭载的载药的平均数量,这与ADC的药理学活性有关,目前获批ADC的DAR范围为2-8。一般来说,体外试验中,高DAR的ADC活性更高,但可能会更快地通过肝脏从血浆中清除。以BrentuximabVedotin为例,在小鼠模型中DAR为8的ADC血浆清除速度比DAR为2的快5倍,性虽然增加了但治疗效果反而更差。临床前研究显示:更高的DAR之所以肝脏清除率更快与抗体-连接子复合物的疏水性增加有关,这可以通过引进亲水性结构来避免。对于药物连接子和DAR不影响血浆清除率的ADC来说,更高的DAR则意味着体内更高的抗肿瘤活性。
Lens周活跃用户数自3月份创新高以来已下降66%:6月30日消息,据Messari称,去中心化社交协议Lens Protocol的每周活跃用户数自3月份达到历史新高以来已下降66%。[2023/6/30 22:10:20]
1.2.6.偶联方式
偶联方式决定了ADC的DAR和均一性,通常分为随机偶联和定点偶联。*随机偶联是指不对抗体本身进行改造,直接利用其表面的赖氨酸残基的烷基化或酰化作用或通过还原二硫键释放半胱氨酸残基与连接子相连,偶联过程随机进行,偶联位置和载药数目不确定,产生的ADC是DAR不一的混合物。这些混合物稳定性差,易发生聚集,动力学性质不一,导致非治疗性副作用,治疗窗窄。*定点偶联技术指的是通过对抗体本身进行改造实现在抗体特定位点连接载药,导致ADC的均一性大为提高,从而降低非治疗性副作用,拓宽治疗窗口,成为ADC开发的重要发展方向。
总的来说:ADC药物发展至今共经历了三代技术变革,在抗体、载药、连接子等方面均有突破。第一代的ADC药物以Gemtuzumabozogamicin为代表,抗体多采用鼠源或嵌合人源化抗体,连接子不稳定,载药的性较低且是随机偶联因而有效性不高,副作用较大;第二代的ADC药物以Brentuximabvedotin和ado-trastuzumabemtansine为代表,采用人源化抗体、性更高的载药、抗体的靶向性也更好,但随机偶联造成的脱靶性仍不可忽视;第三代的ADC药物以fam-trastuzumabderuxtecan为代表,完全人源化的抗体、高性载药以及定点偶联技术的使用使得疗效更好,但高性载药所带来的可能副作用仍存在。
2.ADC全球研发现状
2.1.ADC交易、融资热度持续上升
ADC药物市场空间增长潜力巨大。全球ADC药物市场增长强劲,目前已获批14款ADC药物。根据医药魔方统计,2019年全球销售额为28亿美元,2021年已突破50亿美元。鉴于目前已获批的大多数ADC药物是后线疗法加之一些创新性ADC药物获批不久,市场还在逐渐培育中,预计全球的ADC药物市场将维持高增长率。根据乐普生物招股说明书的披露,预计全球的ADC药物市场2024年及2030年将分别达104亿美元及207亿美元,2019年至2024年的复合年增长率为30.6%,2024年至2030年的复合年增长率为12.0%;中国ADC的市场直至2020年才出现,由于ADC技术的不断突破,研发管线的不断扩容,针对的适应症也不断扩大,中国ADC治疗市场高速增长,预计于2024年及2030年将分别达人民币74亿元及人民币292亿元的规模,2024年至2030年的复合年增长率为25.8%。
相比于传统疗法,ADC拥有无可比拟的优势,激发了全球的开发热情。传统的肿瘤疗法如抗体药物和化疗,均有其各自的局限性。抗体药物的安全性和疗效特征受到批次差异、背景信号干扰和副作用等问题的影响,而化疗则表现出高脱靶性,由于不能有效区分健康细胞和肿瘤细胞而导致感染、脱发和恶心等风险的增加。相比之下,ADC综合了抗体疗法、化疗和小分子抑制剂疗法的主要优势,具有独特的靶向能力,并显示出了更好的临床试验结果,为肿瘤患者提供了更好的治疗选择,表现出了很大的优势。
为了进入该领域,ADC相关的BD交易无论是数量还是金额都直线上升。2020年吉利德以210亿美元的高价收购了ADC公司Immunomedics,创下当年最高交易纪录。盘点2021年我们可以看到第一三共成为最大的赢家,它的两款产品DS-8201和DS-1062均达成了金额超60亿美元的交易。荣昌生物将维迪西妥单抗的海外权益以26亿美元的高价出售给Seagen证明了中国企业的研发实力。2022年2月,强生和礼来分别与ADC公司Mersana和ImmunoGen达成了金额超10亿美元的合作,巨头的入局让该赛道更加火热。
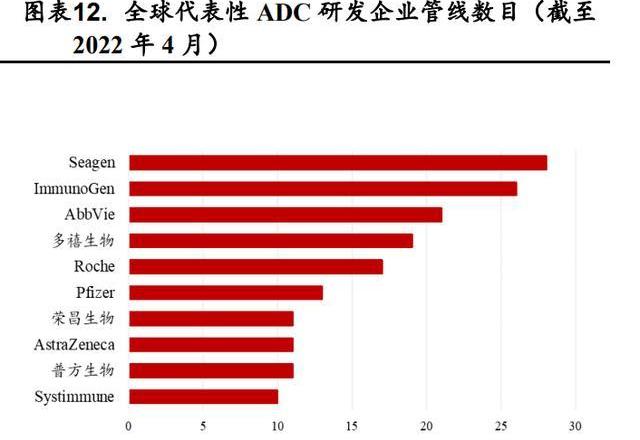
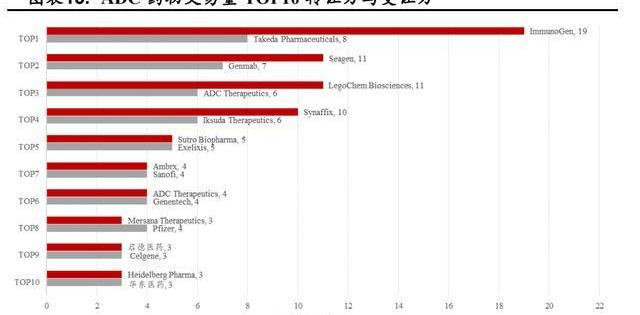
截至2022年4月17日,从ADC相关的交易我们可以看到ImmunoGen、Seagen、LegoChemBiosciences、Synaffix转让的次数最多,证明了它们在ADC领域卓越的研发实力,我国在该领域与国际先进水平尚有较大差距。
分析历年ADC产品交易时所处的研发进度我们可以发现:绝大多数产品处于研发早期,临床前占比76.25%,临床I期占比10%,临床I/II期占比4.4%,临床II期占比2.5%。
盘点过去五年ADC相关的交易我们可以看到:参与ADC交易的中国企业热情非常之高,连续5年成为最大的交易受让方,2021年更是达到了14项之多,而参与交易的这些ADC产品绝大多数针对的适应症均是肿瘤。
从一级市场的融资来看,医药魔方数据显示:2021年国内外ADC药物领域共披露了40多起融资事件,六成以上融资发生在国内,多禧生物的C轮融资达10亿元人民币拔的国内头筹。AOC、ISAC、VDC等ADC药物的衍生物也逐渐进入人们的视野。
2.2.全球ADC药物研发概况
根据医药魔方的数据:全球ADC药物在研管线靶点虽呈现出多样化发展的趋势,但目前主要还是集中在HER2、EGFR、TROP-2、Claudin18.2少数几个热门靶点,其他靶点开发的空间还很大。
从布局的适应症来看,集中度非常高。95.17%的管线布局的适应症均是肿瘤,其次是自身免疫性疾病、细菌感染、湿性年龄相关性黄斑变性等。
2.3.中国ADC药物研发概况
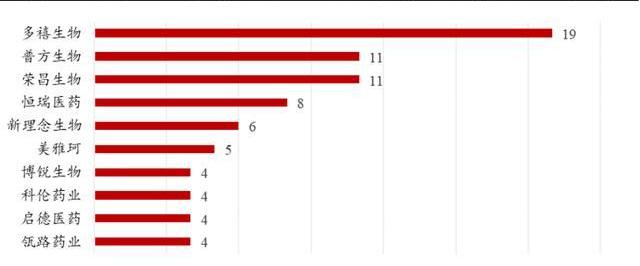
截至2022年4月,根据医药魔方数据库的披露:多禧生物、普方生物、荣昌生物、恒瑞医药是国内布局ADC管线最多的四家企业。
与全球的研发趋势类似,国内ADC在研药物靶点也是集中在HER2、EGFR、TROP-2、Claudin18.2、c-Met、PSMA、CD19这些热门靶点。
从布局的适应症来看,集中度同样也是非常高。95.2%的管线布局的适应症是肿瘤,其次是自身免疫性疾病、细菌感染、湿性年龄相关性黄斑变性等。而在布局的主要肿瘤类型中,又以乳腺癌、非小细胞肺癌、卵巢癌、胃癌、结直肠癌等实体瘤为主。
从研发进度来看,同样绝大多数的研发项目均处于早期开发阶段。其中无申报占比61.82%,临床前占比18.87%,临床I期占比8.24%,临床I/II期占比1.08%,临床II期占比1.95%。
3.全球主要代表性ADC药物
3.1.辉瑞:ADC领域的先驱,推出全球首个ADC药物Mylotarg
Mylotarg原研公司为辉瑞,由靶向CD33的单抗与抗肿瘤抗生素卡奇霉素偶联而成,该药是全球第一个上市的ADC药物,也是获得FDA加速批准的所有新药中第一个退市的药物,同时又是第一个退市后再次上市的ADC药物。目前已获FDA批准的适应症包括:初诊CD33阳性的成人和大于1个月的儿童急性骨髓性白血病;复发或难治性的CD33阳性成人和大于2岁的儿童急性骨髓性白血病。
恒生电子:联盟链的创新空间应集中在如何更好地服务中小和小微企业方面:金色财经报道,6月23日,恒生电子区块链发展部运营经理林晗做客金色财经举办的“联盟链-创新场景应用的偶然与必然”为主题的金色沙龙第64期活动。林晗表示中国的区块链研究和专利成果,从一开始就比较集中在区块链技术的应用和落地,也就是产业区块链方面。现阶段联盟链适用于与具体细分产业相结合的场景,比如说产业金融领域,例如产业金融区块链平台范太链。联盟链的创新空间应是集中如何利用区块链解决小微企业的信任问题、更好提升小微企业运营效率来开展。因为区块链能解决的一个核心痛点是信任问题,与本身就具有信任背书能力的大企业相比,在产业中往往是小企业才需要解决信任问题。区块链作为一种划时代意义的记账技术,其最大的价值是应该被用来与实体产业结合,促进社会发展。[2021/6/23 0:00:23]
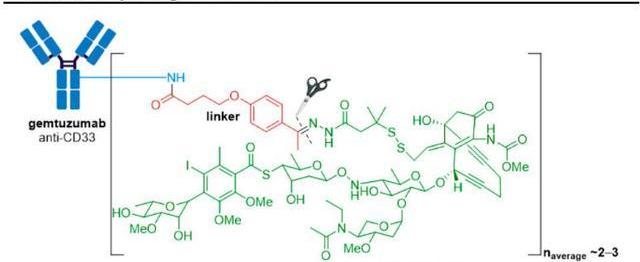
FDA于2000年批准Mylotarg上市用于“60岁以上且不适合细胞化疗的首次复发型CD33阳性AML患者的治疗”,但上市后的验证性Ⅲ期研究发现该药有严重的致死性肝损伤,联合用药组的死亡率高于单独使用化疗组,而且未表现出明显的生存获益。辉瑞于2010年6月主动将Mylotarg撤市,对“给药方案”进行了优化:一方面,通过降低单次给药剂量从而降低副作用,此外还在给药方案中引入“诱导周期”和“巩固周期”以确保疗效。
得益于给药方案的调整,Mylotarg的临床疗效得到了提高:对于AML一线治疗患者,Mylotarg联合化疗组与只接受化疗组的头对头III期临床试验数据显示:Mylotarg组患者的中位无事件生存期从9.5个月延长到了17.3个月,事件风险降低了44%。
对于经历过一次复发的AML患者,MyloFrance-1试验的数据显示:Mylotarg单药治疗可以实现26%的患者完全缓解率,所有患者的中位缓解时间达11.6个月。Mylotarg的波折遭遇凸显了“给药方案”的重要性,目前在ADC的设计中一个趋势就是载药的设计性越来越强,但高性是把双刃剑,需要吸取Mylotarg的教训。总之,Mylotarg在经历撤市风波后重振雄风,一鼓作气更是将AML适应症由原来的后线用药推到了一线用药,给后来者积累了宝贵的经验。
3.2.罗氏:T-DM1巩固其在乳腺癌领域的霸主地位
Kadcyla是罗氏研发的一款HER2ADC药物,由靶向HER2的曲妥珠单抗与抑制微管聚集的化疗药物美坦新通过不可裂解的硫醚连接子MCC连接而成,DAR=3.5,不存在“旁杀者效应”。
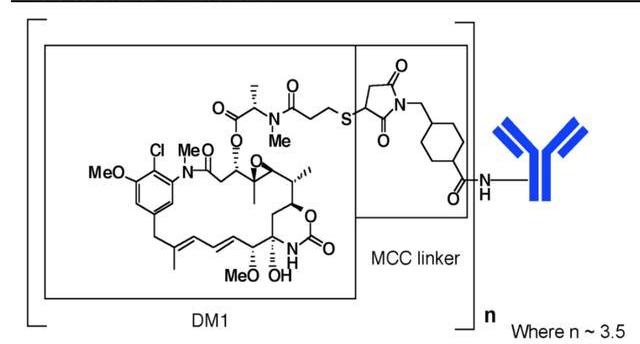
T-DM1是全球第一个获批用于实体瘤的ADC,已获FDA批准上市的适应症包括“HER2阳性早期乳腺癌的辅助治疗”,以及“HER2阳性转移性乳腺癌的二线治疗”,但它在胃癌和NSCLC上并未达到像乳腺癌中的预期效果,T-DM1于2020年1月成为第一个获批上市的ADC药物。
3.2.1.针对HER2阳性早期乳腺癌的辅助治疗
对于经紫杉烷和曲妥珠单抗治疗后仍有残留浸润性肿瘤细胞的HER2阳性乳腺癌患者,T-DM1与曲妥珠单抗头对头的试验结果显示:T-DM1组的3年无浸润性肿瘤复发生存率显著高于单独使用曲妥珠单抗治疗的对照组,将HER2阳性早期乳腺癌患者复风险降低了50%。
3.2.2.针对HER2阳性局部晚期或转移性乳腺癌二线治疗
经曲妥珠单抗或紫杉烷类单药或两者联合治疗后仍有进展的局部晚期或转移性HER2阳性乳腺癌患者,T-DM1单药与化疗组合“拉帕替尼+卡培他滨”的头对头III期临床试验结果显示:两者的中位总生存期30.9个月VS25.1个月;中位无进展生存期9.6个月VS6.4个月;客观缓解率43.6%VS30.8%;中位持续缓解时间12.6个月VS6.5个月,可以说T-DM1完胜化疗组合疗法。基于该试验FDA批准了T-DM1二线治疗HER2阳性转移性乳腺癌,此后T-DM1成为该适应症的标准疗法,目前是全球最为畅销的ADC药物,2021年度全球销售额达21.78亿美元。T-DM1连同曲妥珠单抗和帕妥珠单抗完成了HER2阳性乳腺癌从“术前的新辅助治疗”、“术后的辅助治疗”到“晚期转移性的一线及二线治疗”全疗程覆盖,奠定了罗氏在乳腺癌领域的霸主地位。
3.3.Seagen:Adcetris树立了CD30阳性淋巴瘤治疗的新标杆
Adcetris由靶向CD30的人鼠嵌合单抗Brentuximab、可裂解的瓜氨酸-缬氨酸二肽连接子和微管抑制剂MMAE偶联而成,DAR为4,分子量为153kDa。
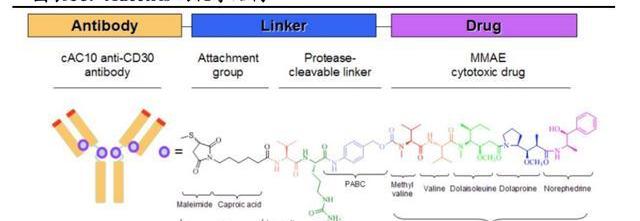
作为血液瘤领域商业化最为成功的ADC药物。目前,Adcetris在全球已获批六项适应症,主要集中在系统性间变性大细胞淋巴瘤、外周T细胞淋巴瘤、经典霍奇金淋巴瘤三个癌种,围绕这三个癌种不断深耕,成功从后线推移到一线,树立了CD30淋巴瘤一线治疗的标杆。

3.3.1.针对CD30阳性经典霍奇金淋巴瘤的一线治疗
在Adcetris之前,CD30阳性经典霍奇金淋巴瘤的标准一线治疗是化疗组合ABVD。Adcetris之前联合AVD与化疗组合ABVD一线治疗晚期经典霍奇金淋巴瘤的头对头随机、开放、多中心3期研究ECHELON-1结果显示:中位随访24.6个月,主要终点分析显示,Adcetris+AVD组和ABVD组患者独立评审委员会评估的2年修订版PFS率分别为82.1%和77.2%,前者降低死亡或疾病进展风险23%,研究者评估的2年修订版PFS率分别为81.0%和74.4%,前者降低死亡或疾病进展风险28%。次要终点分析显示,Adcetris+AVD组VSABVD组,完全缓解率分别为73%vs70%,3%客观缓解率分别为86%vs83%,3.2%。安全性分析显示,Adcetris+AVD组的安全性与单药已知的安全性总体上一致。基于该试验FDA批准了Adcetris一线治疗经典霍奇金淋巴瘤,终结了该领域40多年没有新的治疗方案的历史。
3.3.2.针对CD30阳性外周T细胞淋巴瘤的一线治疗
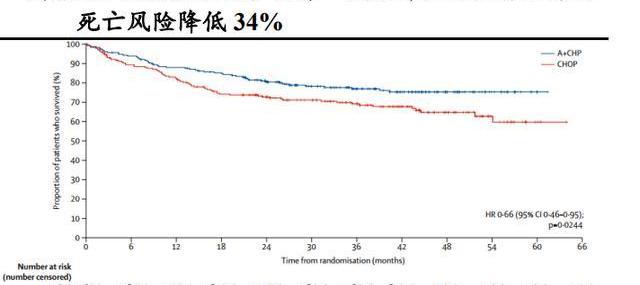
在外周T细胞淋巴瘤一线治疗方面,Adcetris联合化疗方案CHP与公认的治疗PTCL的一线标准治疗方案CHOP的头对头随机、双盲、国际多中心、III期研究试验结果显示:中位随访36.2个月,与标准一线化疗CHOP相比,Adcetris+CHP治疗组可使患者的中位无进展生存期由20.8个月延长到48.2个月,疾病进展风险降低29%,3年无进展生存期由44.4%提高到57.1%,死亡风险降低34%,Adcetris联合化疗方案CHP树立了PTCL治疗的新标杆。
清华x-lab区块链实验室主任夏立:推动技术创新、科技创业创新,提升整个中国的产业转型:金色财经报道,数字岛与清华大学技术创新发展中心联合主办的“产教融合,教育部区块链9大应用校企政合作研讨会”6月21日成功举办。论坛由数字岛发起人兼CEO刘靖主持,汇集校企政共同参与,积极探讨推动九大应用场景落地并建成示范应用。
清华x-lab区块链实验室主任夏立在会议开始发表致辞,表示希望通过这样的创新大会,将技术创新、科技创业创新,提升整个中国的产业转型,也希望产业专家和学术专家能共同来探讨未来政企与高校合作的新的学术方向和教育的方法,从而能够带动高校学生的创新。[2020/6/21]
3.4.阿斯利康/第一三共:DS-8201力压群雄
Euhertu由人源化HER2单克隆抗体曲妥珠单抗通过可裂解的多肽连接子偶联拓扑异构酶I抑制剂喜树碱衍生物构建而成,DAR为8。曲妥珠单抗与肿瘤细胞表面的靶点HER2结合被其介导的内吞作用进入肿瘤细胞,进入融媒体后多肽连接子被裂解,释放出载药DXd抑制拓扑异构酶I的活性,进而引发DNA损伤和细胞凋亡。
3.4.1.针对HER2阳性乳腺癌后线治疗
开放标签、单臂、多中心的II期临床研究DESTINY-Breast01研究显示:184例HER2阳性乳腺癌患者已经使用了两种或两种以上治疗方案,接受DS-82015.4mg/kg的治疗后,中位随访11.1个月,客观缓解率达60.9%;其中4.3%的患者达到完全缓解率;56%的患者达到局部缓解,中位持续缓解时间为14.8个月,中位无进展生存期为16.4个月。这些患者先前均接受过T-DM1治疗,中位治疗线数为6,几乎穷尽HER2阳性乳腺癌治疗手段但仍取得了亮眼的临床数据,显示了其巨大的临床价值。安全性方面间质性肺病/肺炎的发生概率是9%,其中2.6%是致命性的,ILD和胚胎性被FDA列入黑框警告。基于该实验2019年12月FDA批准了DS-8201用于治疗既往已经接受2种及以上HER2靶向疗法的成人不可手术切除或转移性HER2阳性乳腺癌患者。
3.4.2.针对HER2阳性转移性胃或胃食管交界处腺癌后线疗法
开放标签、多中心、随机DESTINY-Gastric01研究显示:对于既往至少接受过二线治疗的HER2阳性胃或胃食管交界处腺癌,DS-8201组相比于对照化疗组,客观缓解率,疾病控制率85.7%vs62.5%;中位总生存期12.5vs8.9个月,死亡风险降低41%,12个月OS率:52.2%vs29.7%;中位无进展生存期5.6vs3.5个月,疾病进展风险降低53%。16例患者发生T-DXd相关的间质性肺病,而化疗组未发生。
3.4.3.针对HER2阳性转移性乳腺癌2线疗法
随机、开放标签、DS-8201和T-DM1的头对头III期临床试验DESTINY-Breast03研究旨在评估二者在既往接受过曲妥珠单抗和紫杉烷治疗的HER2阳性转移性乳腺癌患者中的疗效和安全性。研究结果显示,在524例随机分组的患者中,DS-8201组和T-DM1组12个月无进展生存率分别为75.8%和34.1%。12个月时,DS-8201组和T-DM1组总生存率分别为94.1%和85.9%。DS-8201组确认的客观缓解率为79.7%,而T-DM1为34.2%。
DS-8201确认的客观缓解率为79.7%,T-DM1为34.2%。对DS-8201有反应的患者中,16.1%达到完全缓解,63.6%达到局部缓解,16.9%疾病稳定,1.1%出现疾病进展。调查组和对照组的疾病控制率分别为96.6%和76.8%。
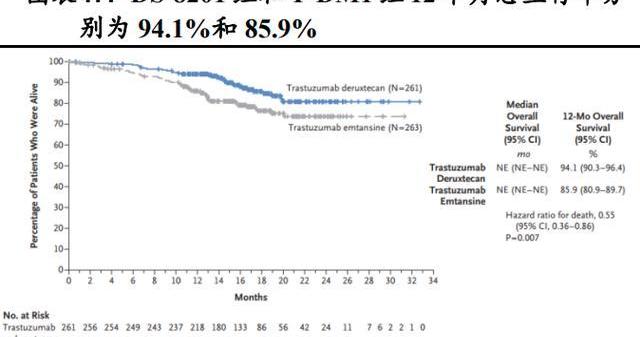
基于该试验2022年5月FDA批准DS-8201用于治疗先前接受过抗HER2治疗方案的不可切除或转移性HER2阳性乳腺癌成年患者。可以说DS-8201完全瓦解了T-DM1作为乳腺癌二线治疗标准疗法的地位,2022版的NCCN指南针对HER2阳性、复发性不可切除或IV期疾病的全身治疗二线方案的推荐DS-8201的级别已经高于T-DM1。2022年全国乳腺癌大会暨中国临床肿瘤学会乳腺癌年会新增DS-8201作为曲妥珠单抗治疗乳腺癌失败患者的治疗的II级推荐,最高的1A证据等级。回溯一下我们可以看到,DS-8201相比于T-DM1的DAR更高,载药不仅性更强,而且均一性也更好,这成为它胜出的重要原因。
3.4.4.针对HER2突变的非小细胞肺癌后线疗法
开放标签、多中心的II期临床试验研究显示:对于标准治疗无效的转移性HER2突变的NSCLC患者,截至2021年5月,中位随访时间为13.1个月,接受Enhertu治疗的91位患者,独立审查委员会确认的客观缓解率达到55%,疾病控制率为92%,中位缓解持续时间为9.3个月,中位无进展生存期为8.2个月,中位总生存期为17.8个月。DS-8201对晚期HER2突变的NSCLC患者显示出持久的抗肿瘤活性,安全性与先前研究的基本一致。49%的患者发生3级或更高级别的药物相关不良事件,最常见的事件是中性粒细胞减少症。26%的患者发生药物相关间质性肺病,并导致2名患者死亡。
DS-8201目前已获得FDA突破性疗法认定,用于治疗携带HER2突变且在铂类药物治疗期间或治疗后发生疾病进展的转移性NSCLC患者。此外,DS-8201一方面在探索与抗PD-1抗体等免疫疗法联用,另一方面还在不断扩大适应症。目前在结直肠癌、三阴性乳腺癌、膀胱癌等癌种中进行临床试验,强悍的临床疗效加上不断扩展的适应症使得DS-8201一时间风头无俩,这就是为什么NatureReviewsDrugDiscovery预测该药将在2026年全球销售额达到62亿美元,占全球最早上市的10款ADC药物近4成份额的底气所在。在中国市场,2020年12月DS-8201获得CDE授予的突破性疗法资格,单药用于既往接受过一种或一种以上治疗方案的HER2阳性局部晚期或转移性胃或食管胃结合部腺癌成人患者的治疗。今年3月21日,DS-8201在国内的上市申请获得NMPA受理。
3.5.吉利德:Trodelvy全球首个获批上市的TROP-2的ADC
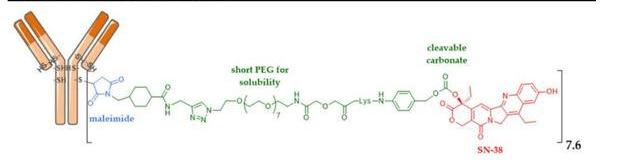
Trodelvy的原研公司是被吉利德以210亿美元收购的Immunomedics,该药由靶向TROP-2抗原的人源化IgG1抗体通过可裂解的连接子与载药拓扑异构酶I抑制剂SN38偶联而成,目前是全球唯一一款上市的靶向TROP-2的ADC药物。
3.5.1.针对三阴性乳腺癌后线治疗
全球性、开放标签、随机III期临床试验ASCENT比较了Trodelvy与化疗单药治疗复发或难治性转移性三阴性乳腺癌患者的疗效和安全性。Trodelvy组的中位无进展生存期相比于化疗组4.8月VS1.7月,疾病进展风险降低了57%,中位总生存期则是11.8月VS6.9月,死亡进展风险降低了49%,客观缓解率31%VS4%。
基于ASCENT试验的结果Trodelvy于2020年4月被FDA批准用于治疗既往已接受至少2种疗法的转移性三阴性乳腺癌成人患者,它也是首款获得FDA批准治疗转移性三阴性乳腺患者的靶向TROP-2的抗体偶联药物,给TNBC患者提供了新的治疗选择。
纽约金融服务局主管:目前需要尽最大努力来管理加密货币风险 同时允许创新:据ccn报道,纽约富有争议的加密货币监管框架BitLicense经常遭到业界的批评,业内人士认为如果其他司法管辖区的监管机构希望在这个新兴领域鼓励创新,就不应该像纽约州这样做。对此,纽约金融服务局(NYDFS)主管Maria Vullo在外交委员会(CFR)主持的小组讨论会上表示,这种观点是幼稚的。Vullo说:“我认为监管机构绝对需要进入加密货币这个领域。我知道公司们在说他们是创新型的,是创业公司,需要被独自放在沙箱里不被打扰。然而幼儿在沙盒里玩耍,大人依照规则。”Vullo还表示,分布式账本技术(DLT)的潜力远远超出了加密货币,并且BitLicense针对的是小范围的有风险的活动。她认为需要将比特币与其背后的技术分开来看,纽约金融服务局不是在监管技术,而是在监管使用这项技术的某些特定活动,这项技术在其他方面也有前途。她补充说明,目前需要尽最大努力来管理风险,同时允许一些新事物蓬勃发展。[2018/6/8]
3.5.2.针对尿路上皮癌的后线治疗
多队列、开放标签、II期注册研究IMMU-132-06结果显示:Trodelvy针对接受过含铂化疗联合PD-1抑制剂或PD-L1抑制剂的局部晚期或转移性尿路上皮癌患者,中位随访9.1个月时,客观缓解率为27%,中位持续缓解时间为7.2个月,中位无进展生存期为5.4个月,中位总生存期为10.9个月。
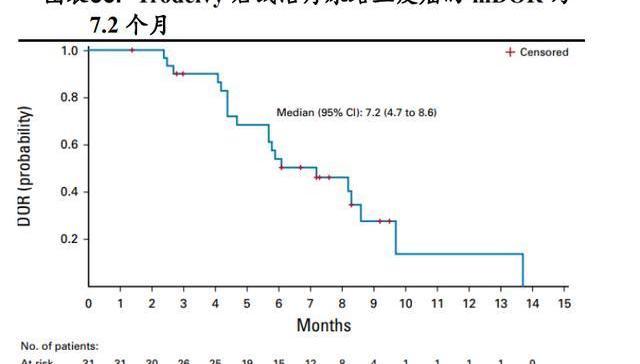
基于TROPHY-U-01试验,2021年4月,Trodelvy又被FDA加速批准用于治疗含铂化疗联合PD-1抑制剂或PD-L1抑制剂的局部晚期或转移性尿路上皮癌成人患者。2022年3月7日吉利德公布了Trodelvy治疗先前已接受过内分泌治疗、CDK4/6抑制剂、2至4线化疗方案的HR+/HER2-转移性乳腺癌患者的临床3期TROPiCS-02研究结果:该研究达到了主要终点,与化疗组相比,Trodelvy治疗组无进展生存期有统计学意义的显著改善。主要终点结果与临床1/2期IMMU-132-01研究中观察到的结果一致,安全性结果也与之前的研究一致,详细的临床数据将在后续的学术会议上公布。Trodelvy所靶向的TROP-2抗原在多种肿瘤细胞中均大量表达,理论上该药对这些实体肿瘤均有治疗潜力。目前Trodelvy或单药或与抗PD-1单抗等药物联用针对转移性非小细胞肺癌等实体瘤开展了多项临床试验探索,未来具有较大想象空间。
4.国内重要代表性ADC药物
4.1.荣昌生物:RC48国内ADC药物的先行者
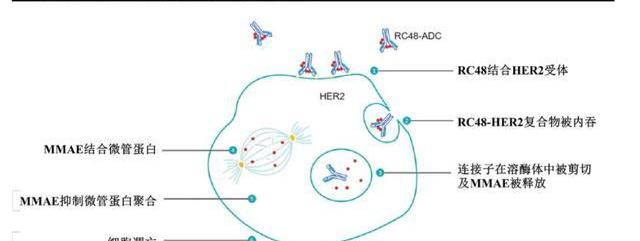
维迪西妥单抗是一种新型的靶向HER2的抗体偶联药物,由重组的人源化HER2IgG1单克隆抗体Disitamab通过可裂解的连接子MC-Val-Cit-PAB与微管抑制剂单甲基澳瑞他汀E偶联而成,DAR=4。
RC48的抗体部分结合至肿瘤细胞表面HER2的胞外结构域后,ADC复合物经细胞内吞并转运到溶酶体,连接子经酶切后释放出微管抑制剂MMAE,破坏细胞内微管网络,导致有丝分裂细胞周期停止和细胞凋亡。此外,体外研究显示RC48可抑制HER2受体信号,并具有抗体依赖细胞介导的细胞性作用。
4.1.1.针对HER2过表达胃癌的后线治疗
开放性、多中心、单臂II期的临床试验C008研究招募的127名至少接受过2个系统化疗的HER2过表达局部晚期或转移性胃癌)患者,每两周接受一次2.5mg/kg的RC48治疗,直至发生疾病进展、不可耐受性、死亡或患者撤回知情同意书。公司分别于2019年12月17日和2020年6月22日开展了阶段性临床数据分析,并于2021年1月25日完成了末例受试者入组后12个月的生存随访分析。截至2020年6月22日的阶段性临床数据分析,独立审查委员会评估确认127名患者的客观缓解率为24.4%,中位无进展生存期为4.1个月,中位总生存期为7.6个月。安全性方面,在127名患者中,最常报告的TRAE为白细胞计数降低,脱发,中性粒细胞计数降低及乏力。
基于该临床试验,RC48于2021年6月获国家药监局附条件批准上市,用于接受过至少两种系统化疗的HER2过表达局部晚期或转移性胃癌患者的治疗。此外,2018年7月FDA授予了RC48用于治疗胃癌的孤儿药资格认定,可在美国享有上市批准后RC48对胃癌的七年市场独占期。公司2020年9月向FDA提交了RC48用于治疗胃癌的II期临床试验的IND,并于2020年11月获得FDA的快速通道资格认定,公司将择机启动该实验。此外,公司未来将择机向欧洲EMA提交RC48治疗胃癌的临床试验申请。
4.1.2.针对HER2过表达尿路上皮癌后线疗法
RC48单药治疗HER2过表达的尿路上皮癌UC的注册性II期临床试验募集了64名HER2过表达局部晚期转移或不可切除的尿路上皮癌患者的中位年龄为62.5岁,89.1%存在内脏转移,85.9%曾接受过至少两种化疗,29.7%曾接受过免疫检查点抑制剂治疗。这些患者每两周接受一次2mg/kg剂量的RC48单药治疗,直至发生疾病进展、不可耐受性、主动退出、死亡或申办方终止研究。结果显示:总客观缓解率为50.0%,疾病控制率为76.6%。中位无进展生存期为5.1个月,中位总生存期为14.2个月。
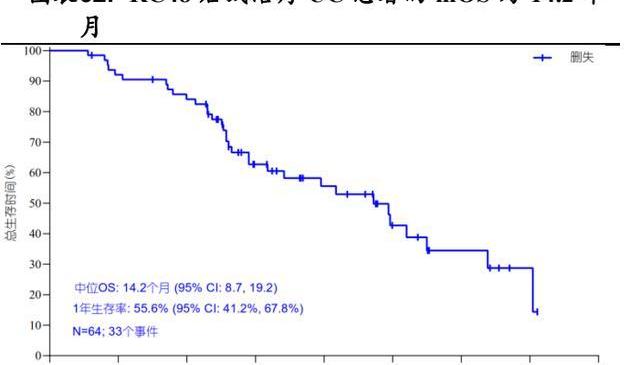
基于该临床试验RC48于2022年1月获得国家药监局附条件批准上市,用于接受过至少两种系统化疗的HER2过表达局部晚期或转移性尿路上皮癌患者的治疗。与此同时,RC48也于2020年4月获FDA批准在美国开展治疗治疗尿路上皮癌的II期临床试验,并在2020年7月和2020年9月获得美国FDA授予治疗尿路上皮癌的快速通道资格与突破性疗法认定。
4.1.3.针对不限HER2表达状态的尿路上皮癌
公司开展的RC48联合特瑞普利单抗治疗局部晚期或转移性尿路上皮癌的Ib/II期研究者发起的研究入组了19名不限制HER2表达状态、无法耐受或拒绝一线含铂化疗的局部晚期转移性或不可切除的尿路上皮癌患者。截至2021年4月初步结果显示,在19例入组患者中,共17例患者完成了至少1次疗效评价,其中16例患者达到缓解,总客观缓解率为94.1%,包括3例完全缓解、13例局部缓解。绝大多数患者在第一次疗效评价时出现缓解。对于不同的既往化疗线数、HER2表达状态,客观缓解率较为一致,其中一线治疗患者的客观缓解率达到100%,HER2表达患者的客观缓解率达到100%。
4.1.4.针对HER2阳性乳腺癌
开放标签、剂量递增的I期临床试验,共招募及治疗了70名HER2阳性乳腺癌患者。主要试验终点为评估RC48的最大耐受剂量、安全性和明确II期临床试验的推荐剂量。截至2020年12月31日,结果显示:接受1.5mg/kg、2.0mg/kg及2.5mg/kg剂量的患者亚组,总客观缓解率分别为22.2%、42.9%及40.0%,中位无进展生存期分别为4.0个月、5.7个月及6.3个月。
英国财政部着手研究数字货币和区块链监管 “不扼杀创新”成关键词:英国财政部委员会已启动对英国数字货币的调查,以监管这一新兴资产类别。调查将研究该技术对金融机构和基础设施的潜在影响,以及监管如何在“不扼杀创新”的情况下为消费者和企业提供保护。调查还将考量政府、金融行为监管局(FCA)和英格兰银行对数字货币的监管反应。财政部委员会主席、国会议员Nicky Morgan表示国内人们越来越关注比特币等数字货币,但他们可能并不知道数字货币目前在英国受到监管,因而个人投资者也没有保护。他认为非常有必要在监管数字货币和为消费者和企业提供充分的保护之间取得平衡,同时也不能扼杀创新。[2018/2/25]
4.1.5.针对HER2低表达乳腺癌
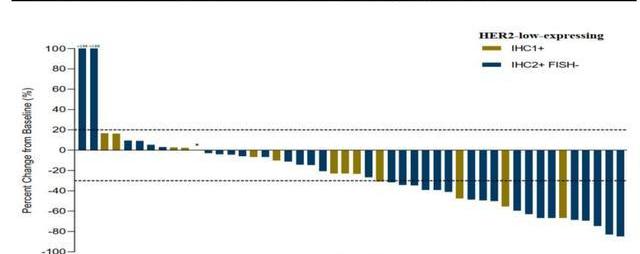
公司开展的开放标签设计的Ib期临床试验,招募了48名HER2低表达乳腺癌患者,均采用一个剂量治疗。结果显示,总客观缓解率和中位无进展生存期分别为39.6%和5.7个月,其中35名IHC2+/FISH-患者的客观缓解率和中位无进展生存期分别为42.9%和6.6个月,13名IHC1+患者的ORR和mPFS分别为30.8%和5.5个月。RC48表现出了对HER2低表达乳腺癌的良好的治疗潜力,有望填补该巨大的治疗市场的空白。
除HER2表达胃癌、尿路上皮癌、乳腺癌之外,荣昌生物还在积极开展RC48用于治疗HER2表达胆道癌、非小细胞肺癌等多种实体瘤的临床研究。
4.2.浙江医药:ARX788有望挑战DS-8201
浙江医药的ARX788是一款HER2-ADC药物,于2013年6月从美国AmbrxBiopharma公司引进。ARX788的抗体部分曲妥珠单抗的重链有对乙酰苯丙氨酸121和对乙酰苯丙氨酸114两个插入的非天然氨基酸,pAF上的酮官能团与载药微管蛋白抑制剂AS269的羟胺基团特异性结合形成肟键,从而产生均质的ADC药物,pAF-肟键极其稳定,不可切割,体内代谢产物仅有pAF-AS269,而无游离素AS269,该代谢物可以被HER2阳性细胞高效内吞和释放,从而极大提高了有效性与安全性。
AmbrxBiopharma公司的非天然氨基酸定点偶联技术制备的ADC药物90%以上DAR为2,其余则是DAR1,实现了ADC药物非常高的均一性水平。临床前研究显示:与传统半胱氨酸偶联产生的DAR为4.5的ADC相比,DAR为2的ARX788的抗肿瘤活性更高。
4.2.1.针对HER2阳性晚期或转移性乳腺癌后线治疗
ARX788在国内进行的针对HER2阳性晚期或转移性乳腺癌患者的临床1期剂量爬坡研究ACE-Breast-01显示,截止到2021年12月14日,ARX788在1.5mg/kg组中已确认的客观缓解率为66%,疾病控制率为100%,在1.3mg/kg组中已确认的客观缓解率为50%,疾病控制率为88%。瀑布图显示1.5mg/kgQ3W组有3名患者,1.3mg/kgQ3W组和1.3mg/kgQ4W组各有1名患者病变100%减少,证明ARX788具有快速、深入、持久的治疗肿瘤的潜力。目前针对该适应症正在国内开展II/III期临床研究。基于良好的临床数据,2021年5月国家药监局授予ARX788二线治疗HER2阳性转移性乳腺癌的突破性疗法认定。
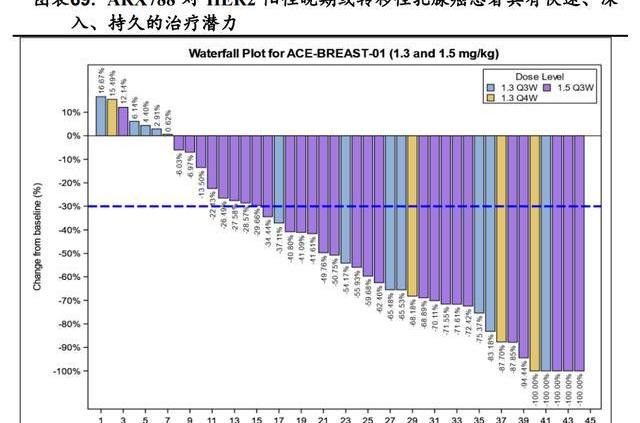
4.2.2.针对HER2阳性晚期胃癌二线疗法
ARX788针对先前曲妥珠单抗的治疗失败的HER2阳性晚期胃癌患者的I期剂量扩增试验研究显示,截至2021年4月7日ARX788在1.5mg/kg组中已确认的客观缓解率为46%,疾病控制率为46%,在1.3mg/kg组中已确认的客观缓解率为43%,疾病控制率为57%。尚未观察到剂量限制性性,也未达到最大耐受剂量,目前针对该适应症正在国内开展II/III期临床研究。
4.2.3.针对泛癌种
在美国和澳大利亚进行的一项ARX788针对HER2阳性实体瘤的I期剂量递增试验研究结果显示,截止到2021年4月8日ARX788在1.5mg/kg组中已确认的客观缓解率为67%,疾病控制率为100%,在1.3mg/kg组客观缓解率未获确认,但疾病控制率为100%。而且发现对于既往接受过T-DM1和DS-8201治疗失败的患者,ARX788仍能带来临床缓解。
4.3.科伦药业:A166兼顾有效性和安全性的第三代ADC
A166是第三代靶向HER2的ADC,通过蛋白酶可裂解的连接子将曲妥珠单抗与新型载药微管蛋白的抑制剂Duo-5定点偶联。
4.3.1.针对HER2阳性乳腺癌后线治疗
A166单药治疗经过多线治疗的HER2阳性乳腺癌患者的I期剂量扩展研究共募集了58例HER2阳性乳腺癌患者,这些患者接受抗HER2治疗线数为4,所有患者均接受过曲妥珠单抗±帕妥珠单抗治疗,94.8%的患者接受过靶向HER2的TKI治疗,20.7%的患者接受过HER2-ADC治疗。试验结果显示,截至2021年12月10日,有效性方面:4.8mg/kg组和6.0mg/kg组,客观缓解率分别73.91%和68.57%;中位无进展生存期分别为12.30月和9.40月。4.8mg/kg组有1例确认完全缓解的患者维持了超过7个月。在数据截止时间,仍有24例患者在继续接受A166治疗。安全性方面:发生≥3级治疗相关不良事件为角膜上皮病变,视力模糊和溃疡性角膜炎。整体不良反应可控,发生眼部不良事件的患者经用药调整和对症治疗后,均可恢复。相比于同靶点已上市的HER-2ADC药物,A166在安全性方面具有明确的优势。为更好地平衡疗效和安全性,A166在II期临床研究的推荐剂量为4.8mg/kg。截至目前,A166首发适应症HER2+乳腺癌关键II期多中心注册临床研究已完成入组,正在进行Pre-NDA的准备工作。Ib期拓展试验包括NSCLC、结直肠癌和胃癌,正快速推进入组。
5.ADC药物当前面临的挑战
ADC作为国内继以抗PD-1单抗为代表的第一波创新药之后技术成熟度最高的药物发展方向,激发了各大药企的热情,成为兵家必争之地。但药物的研发要实现临床有效性和安全性的统一,不能顾此失彼,Mylotarg从上市到退市再到重新上市的历程充分说明了安全性在药物研发中的重要性。各大药企分别从ADC的各个组成要素切入,以求得到具有高临床价值的ADC产品,但ADC药物作为一个非常复杂的实体,并非几个要素简单组合一下就对患者具有临床获益,即使现在最新一代ADC药物中采用的定点偶联技术也不能保证能研发出疗效良好的产品,代表性的如基因泰克研发的vadastuximabtalirine、AstraZeneca/MedImmune开发的MEDI4276均因安全性问题而折戟沉沙。由此可见,ADC的开发当前仍面临不少挑战。
5.1.复杂的药代动力学特征
ADC给药后,主要以结构完整的ADC、裸抗体和游离的载药三种形式存在于体循环中,随着ADC识别靶抗原、内化、去偶联这三种存在形式处于动态变化中。典型的ADC药代动力学特征是结构完整的ADC和裸抗体的浓度随着ADC的内化和抗体的清除而不断降低。影响抗体清除的因素包括单核吞噬细胞系统和Fc受体介导的再循环。通过与内吞液泡中的ADC结合,FcRn将ADC输出到细胞外区室进行重复利用。因此,包括结构完整的ADC和裸抗体在内的抗体通常比传统小分子药物半衰期更长。至于游离的载药主要在肝脏代谢,通过尿液或粪便排出体外,这个过程可能会受到药物相互作用和肝肾功能损害的影响。以上所有因素再加上患者的个体差异性导致难以建立PK和PD模型来描述ADC的临床特征并辅助于新型ADC的设计。
5.2.难以避免的副作用
“脱靶、脱肿瘤”相关不利事件似乎主导了大多数现有ADC的性特征。对现有数据的荟萃分析表明,不同的载药小分子具有明显的性特征,而且与靶抗原无关。比如MMAE与贫血、中性粒细胞减少、周围神经病变相关,DM1与血小板减少和肝性相关,MMAF和DM4与眼部性相关。目前已经批准上市的14种ADC中,最常见的大于等于3级的严重副作用是血液性,包括中性粒细胞减少、血小板减少、白细胞减少和贫血。血液性、肝性和胃肠道反应等脱靶性可能与载药过早释放到血液循环、非肿瘤组织或肿瘤微环境中以及载药对健康组织的后续影响有关,这类副作用与常规化疗药物影响快速增殖的健康细胞一致。
ADC的抗体部分诱导的免疫反应可能会引起继发性损伤,从而导致肾性。
近来在HER2ADC的研究中发现ADC药物会引起潜在的肺性作用,这个现象应引起注意。在T-DM1和DS-8201的临床研究中有被报道的与ILD相关的几例死亡病例,但ILD的发病机制仍不清楚。肺中的血流量丰富ADC停留的时间最长,这样会造成ADC的不良摄取以及血液中的游离载药会诱发肺病如ILD。
5.3.ADC的聚集
作为ADC的重要组成单元,抗体在ADC的整个全生命周期都有发生聚集的可能性,抗体一旦聚集不仅会造成产品损失,还会降低ADC与靶抗原的结合能力。外界的物理、化学等多种因素如高温、低pH都会导致ADC空间结构发生变化,引起蛋白质聚集。因为暴露在抗体表面的负责抗原特性的氨基酸序列不同,每种抗体的互补决定区也不同,每种抗体的稳定性要求也不同,给解决蛋白质聚集问题带来了很大挑战。
5.4.肿瘤靶向和有效载荷释放
相比于传统的化学药小分子,ADC因为偶联了抗体显然分子量要大得多,这样会造成ADC穿透肿瘤微环境达到肿瘤细胞的效率有限。静脉注射的ADC药物最终能到达肿瘤组织的仅占2%,这也就是为什么在设计ADC时需要考虑载药的性。一方面为了降低其它绝大多数不到达肿瘤组织的剧载药带来可能的系统性,抗体与载药之间的连接子要足够稳定,另一方面为了确保载药进入细胞后能顺利释放,连接子也不能太稳定,因此在设计ADC的时候需要权衡这一点。ADC到达肿瘤组织后通过形成ADC-抗原复合物内化进细胞内部,酸性可裂解连接子的ADC被转运到早期内吞体中,需要蛋白酶裂解的ADC会被转运到晚期内吞体和溶酶体中。靶抗原表达的高异质性对于内化到细胞内的ADC抗肿瘤活性具有重要意义。在设计ADC的时候选用可裂解的非极性载药可以有效穿越细胞膜,更好发挥ADC的“旁杀者效应”对周围不表达抗原的肿瘤细胞发挥杀伤作用。
5.5.ADC的免疫原性
ADC是人工合成的生物大分子药物,对于人体来说同样属于异物,具有诱导免疫原性的潜在风险,若进入人体后的ADC诱导产生的抗药物抗体与人体内源的蛋白交叉反应会对ADC本身的临床疗效产生影响,这在临床研究中必须予以评估。
5.6.耐药性
抗原相关耐药一方面是肿瘤细胞表面表达的靶抗原下调使ADC缺少识别的靶标无法发挥细胞性作用;另一方面靶抗原的高表达使肿瘤细胞表面暴露的ADC减少同样会降低ADC的有效性比如外周血中表达过高的CD33抗原会消耗Mylotarg,从而限制其在骨髓中的渗透;其次,抗原胞外的结构域被截断或肿瘤微环境中的细胞外基质成分阻挡了肿瘤细胞表面抗原的暴露同样无法使ADC无法发挥细胞性作用;最后则是抗原配体的存在可以调节肿瘤细胞对ADC的敏感性。
肿瘤细胞内吞转运ADC功能受损ADC需要被肿瘤细胞内吞到细胞内部而发挥疗效,该过程通常通过clathrin-mediated、caveolin(CAV1-mediated、clathrin-caveolin非依赖性内吞等途径完成,倘若肿瘤细胞无法正常内吞ADC会产生耐药作用。
溶酶体功能障碍ADC进入细胞后到达溶酶体,被其中的酸性化学或者蛋白水解酶裂解释放载药发挥细胞杀伤作用。一方面若溶酶体pH增加,会抑制蛋白水解酶,从而产生耐药作用,另一方面溶酶体膜对在溶酶体中ADC分解代谢产生的底物通透性差,使载药不能进入细胞质从而也会产生耐药作用。
载药转运蛋白药物转运蛋白ATPbindingcassettetransporters或MDR1将细胞质的载药从细胞内转运到细胞外使其无法发挥完成细胞杀伤作用。
靶点突变载药作用的靶标蛋白结合位点发生突变。
细胞周期细胞周期动力学可能会影响肿瘤细胞对ADC的敏感性。研究发现处于分裂期的白细胞对Mylotarg的吸收更敏感,而没有处于分裂期的白细胞不仅吸收Mylotarg低效而且对载药刺孢霉素性作用不够敏感。
激活信号通路下游信号通路的激活可能有助于增强肿瘤细胞对ADC的耐药性,体外研究发现激活PI3K/AKT信号通路使得原代AML细胞对Mylotarg耐药性增强。
细胞凋亡调节异常细胞凋亡调节的变化也会影响ADC的敏感性。研究发现无论是促凋亡蛋白BAX和BAK还是抗凋亡蛋白BCL-2、BCL-X都会影响AML细胞对Mylotarg的敏感性,体内研究显示BCL-2蛋白的抑制剂ABT-263可以增强ADC的活性。
6.后DS-8201时代ADC药物开发该何去何从?
虽然DS-8201在ADC时代极具统治力,但回顾历史、分析当下,我们认为ADC赛道足够广阔,其他药企还有机会,应坚定信心,迎难而上。ADC药物集现代制药工业之大成,开辟了肿瘤治疗的新边疆,宣告了立体肿瘤免疫时代已经来临。ADC技术平台虽然研发壁垒高,但外延价值大,可以组合迭代出丰富的产品组合,极大扩充研发管线,增加企业研发试错的可选项和后续的发展潜力。国内药企在ADC研发这一领域可以说开发热情非常之高,从以百奥泰BAT8001为代表的第一代简单粗暴模仿罗氏的T-DM1,到第二代以荣昌生物RC48为代表的对抗体、linker、payload进行有限改良,再到现在大力发展定点偶联技术为代表的第三代ADC,总体来说保持了持续向好发展的态势。
第一三共的DS-8201获批上市以后给全球各大ADC开发企业都带来了较大压力,我们看到其竞品无论是Seagen的HER2TKI产品tucatinib还是罗氏的HER2ADC产品T-DM1都受到了DS-8201快速成长带来的冲击,或调低销售预期或趁DS-8201还未在中国市场上市利用时间差降价以快速抢占市场。T-DM1作为实体瘤治疗领域的标杆性ADC药物,是国内众多药企模仿学习的对象,T-DM1面对DS-8201尚且委曲求全,这让众多国内药企情何以堪。但DS-8201并非完美无缺,首先从安全性方面来看,在多个适应症中发现DS-8201会引发间质性肺炎,具有致死性,被FDA列入黑框警告;其次,DS-8201的价格不友好,在香港购买该药品7-8万/月,这让绝大多数国内患者望而却步。
创新者生,守旧者亡。面对DS-8201的压力,我们看到已经出现了一些苗头有望与之竞争。对于HER2阳性乳腺癌的后线治疗新码生物的ARX788I期剂量爬坡研究的结果患者的临床获益率不输于DS-8201,但安全性却更好;此外,针对HER2阳性实体瘤的泛癌种I期剂量递增试验中对于既往接受过T-DM1和DS-8201治疗失败的患者,ARX788仍能带来临床缓解。同样科伦药业的A166针对HER2阳性乳腺癌的后线治疗I期剂量扩展研究中表现出对患者的临床获益率不输于DS-8201,而且整体不良反应可控。由此可观,DS-8201的技术路线并非是ADC开发的唯一优化路径,在ADC这个领域是可以走出一条差异化发展之路的。
6.1.靶点多元化
目前无论是全球还是国内ADC研发在HER2等少数靶点上过度集中,造成严重内卷,靶点布局可以向常规竞争格局良好的靶点、突变蛋白靶点、双靶点方向转移。
6.1.1.常规竞争格局良好靶点
FRα:FRα在正常组织中表达较少,但却在多种实体瘤中过度表达,目前尚无任何针对FRα靶点的药品获批上市。2020年10月,华东医药引进Immunogen靶向FRα的ADC新药MirvetuximabSoravtansine的中国权益,该药也是目前全球开发最快的FRαADC药物,在FRα高表达的复发性卵巢癌患者中取得的积极数据有望加速其获批上市,原研公司Immunogen正在开展III期临床试验。除了华东医药外,针对FRαADC2021年12月天士力引进了Sutro公司开发的STRO-002。STRO-002是一款第三代定偶联ADC药物,DAR值为4,产品均一性高,目前Sutro公司针对卵巢癌/子宫内膜癌正在开展I期临床试验。
EGFR:EGFR在多种肿瘤中过度表达,已成为多种成功上市的治疗药物的活跃靶标,目前尚无靶向EGFR的ADC产品上市。乐普生物的MRG003是目前国内处于临床研究阶段的首创的靶向EGFR的ADC药物,有望填补EGFR靶向药物二线及以上全身性治疗失败的EGFR阳性晚期或转移性实体瘤患者未被满足的医疗需求,在临床上具有广阔应用前景。I期剂量爬坡和剂量扩展试验的结果显示,MRG003在EGFR阳性头颈部鳞癌和鼻咽癌患者中表现出可管理的安全性特征和有前景的抗肿瘤活性,在结直肠癌中需要进一步探索疗效预测指标,寻找可能的获益人群。研究者目前已在晚期SCCHN和NPC患者中启动了II期临床研究。
6.1.2.突变蛋白靶点
突变蛋白比野生型蛋白通常具有更高的泛素化水平意味着更容易被降解,而且它也更容易被细胞内化。如果选用致癌突变蛋白作为靶抗原,不仅可以提高肿瘤治疗的特异性,还可以提高ADC的内化水平进而提高临床疗效。
6.1.3.双靶点
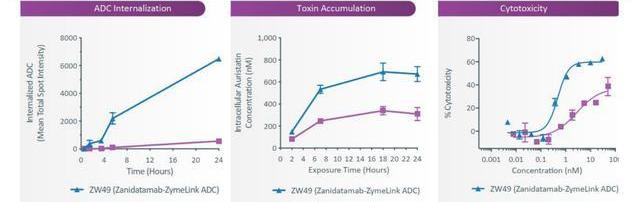
双靶点特异性抗体技术为ADC创新带来了新的可能,这种设计可以改善抗体内化并提高肿瘤特异性。Zymeworks利用其Azymetric和ZymeLink技术平台开发的双特异性抗体-药物偶联物(ADC)是在其开发的双靶点特异性抗体Zanidatamab基础上偶联了载药MMAE而成。ZW49目前正在进行一项I期临床试验,单药治疗局部晚期或转移性HER2阳性实体瘤患者。研究发现相比于单靶点特异性抗体ADC,双靶点特异性抗体ADC药物ZW49在HER2表达的细胞内内化水平更高,募集的载药更多,细胞性也更强。
6.2.适应症的多元化
目前DS-8201在乳腺癌、胃癌、NSCLC等适应症上表现出了强大的竞争实力,其他产品在适应症上的布局上,一方面避免与DS-8201“撞车”,学习Mylotarg、T-DM1适应症从后线向前线布局推进,另一方面要精准匹配适合药物本身的适应症人群。
6.2.1.避免与DS-8201“撞车”
国内ADC开发的情况是不少企业不仅在靶点上扎堆,而且在适应症上也扎堆,现在DS-8201出来后这些“撞车”企业的压力会很大。荣昌生物之所以能成为第一个国产ADC获批的药企,很大程度上归功于适应症的选择。临床急需,竞争格局良好的适应症,不仅在开展临床试验时容易募集患者,节省研发成本,而且会加快研发进度,成功上市后,商业化前景也是可期。像RC48针对的胃癌、尿路上皮癌的后线治疗,抑或是HER2低表达的乳腺癌都是如此。在适应症的选择上避开DS-8201的优势项目,不仅降低将来与DS-8201做头对头试验的风险,而且很可能通过单臂或者与化疗做对照就可以申报上市,跑赢竞争对手。
6.2.2.前线后线治疗全面开花
目前获批的ADC大多针对的是适应症的后线治疗,然后逐步尝试前移。通常来说前线比后线的患者人群要多,治疗难度要小,因此药企在考虑适应症布局的时候不仅要盯着后线治疗,还要考虑前线治疗乃至辅助/新辅助治疗。
6.2.3.精准匹配适应症人群
ADC药物是通过抗体去识别靶抗原进而杀死肿瘤细胞,但不同肿瘤细胞靶抗原的密度是不同的,对ADC的反应也是有差异的,有时候没有观察到临床获益可能只是群体的平均结果掩盖了真相,细分人群中可能存在临床获益。华东医药引进的ImmunoGen靶向FRα的ADC新药MirvetuximabSoravtansine,当初作为单药治疗铂耐药卵巢癌的疗效和安全性的临床III期研究FORWARDI,初次分析该临床结果发现不限FRα表达状态的全部入组人群中主要临床终点PFS与化疗组并无显著性差异,随后却在FRα高表达的亚组患者中发现相比于化疗对照组患者具有临床获益。由此可见,在适应症的选择上精准匹配适用人群对于ADC的成功开发也至关重要。
6.3.联合治疗前景广阔
没有一种抗肿瘤药物可以100%有效,所以联合不同作用机制的治疗药物以提高临床获益是当下开发肿瘤治疗药物的常用策略。既往研究显示,化疗药物、小分子靶向药物联合抗PD-1/PD-L1单抗,疗效通常高于抗PD1/PD-L1单药本身。在ADC的临床研究中发现了同样的现象,多个临床研究发现HER2ADC联合抗PD-1单抗可以显著提高疗效。ADC类药物也可与小分子或大分子抗血管生成药物联合使用。但值得注意的是,ADC本身携带细胞性分子,如果与其他化疗药物联合使用,反而会增加安全隐患,因此化疗药物通常不作为ADC的首选联合治疗策略。
ADC通常的联合给药策略如下:抗血管生成剂,在一定程度上会改变肿瘤血管系统,从而改善ADC向肿瘤组织的递送,增强ADC的细胞性作用;促进肿瘤细胞表面靶抗原表达的药物可能会促进抗体-抗原结合,或者促进ADC-靶抗原复合体内化的药物会增加肿瘤细胞摄取ADC从而增强细胞性;与ADC的载药可以形成互补机制或合成致死作用的其他药物可以进一步增强载药的细胞性;促进募集激活的免疫效应细胞的药物可以增强抗体依赖性细胞性作用或细胞介导的肿瘤识别和免疫效应功能,有助于增强ADC诱导的肿瘤杀伤作用。
6.4.泛偶联极大丰富ADC的发展空间
时至今日,随着技术的进步ADC不仅在结构上早已突破经典的抗体+连接子+载药模式,核素偶联药物、小分子偶联药物、多肽偶联药物、双环肽偶联药物、免疫刺激偶联药物、抗体偶联siRNA、细胞偶联抗体、多弹头ADC等新概念ADC药物如雨后春笋般冒出来,而且在应用场景上已不再局限于治疗肿瘤,自身免疫疾病等其他适应症也成为新的开发热土。因而,掌握ADC平台型技术的企业可以发挥的空间非常大,将在这个领域大展拳脚。
泛偶联将小分子药物与生物大分子药物交叉组合在一起,使候选药物分子的数量呈指数级爆炸增长,可以想象制药工业将迎来蓬勃发展的新时代。但到目前为止,除了少数几个多肽/核素偶联药物获批上市之外,泛偶联药物还处于早期探索阶段,发展并不乐观。MersanaTherapeutics的靶向NaPi2b的用于治疗卵巢癌的多弹头ADC药物UpifitamabRilsodotin,DAR高达10-12,临床I期中期数据显示该药引发了严重的副作用,而且量效关系相反。BoltTherapeutics的HER2-TLR7/8ISAC药物针对HER2阳性实体瘤的早期临床试验数据显示患者的临床获益率很低,40例可评估患者中总缓解率ORR仅为2.5%。同样致力于开发ISAC药物的SilverbackTherapeutics的SBT6050与K药联用治疗HER2阳性实体瘤的临床I期数据显示,患者的临床获益率也很低,14例可评估患者中总响应率ORR仅7%。总而言之,泛偶联是一个新的制药思路,给制药企业带来了更多探索的可能性,可以帮助制药企业走出一条差异化发展之路。
6.5.小结
组成ADC的四大要素的理想特征是:抗体:靶向肿瘤特异抗原二者亲和力高,细胞内化效率高、无免疫原性;连接臂:血液循环中稳定,细胞内可快速裂解;连接方式:定点偶联,产生的ADC均一性高;载药:性强,IC50值在0.01-0.1nM;水溶性强;血清中稳定。但在实际开发中我们不可能把每种最优的要素全部集合在一起,因为ADC本身是一个非常复杂的结构实体,CMC的可行性和难度对于最终能否开发出来一款成功的ADC药物起了决定性作用。
正如每个人都有自己的能力圈,只能赚自己认知范围内的钱一样。对于ADC来说也是如此,不存在一款药物可以通吃绝大多数适应症也不仅仅只存在一种研发范式。不同的癌种微环境不同,靶标不同,选用何种抗体、载药、连接子、连接方式都不可能照搬其他癌种的做法,ADC研发的根本原则就是立足于适应症本身,实现安全性和有效性的有机统一,尽可能提高患者的治疗窗口。所以,泛偶联时代其他药企仍然可以走出一条差异化发展之路。充分发挥自身优势,遵循根本原则,满足未被满足的临床需求,只要在某一点上取得突破可能就会有惊喜。后DS-8201时代,面对眼下肉眼可见的压力,反而可以倒逼国内药企思考做真正的创新与优化设计,并最终转化为临床上的高临床价值药物。
精选报告来源:。
作者|Ignes 编译|白泽研究院 2022年的加密熊市来得突然,并且如火如荼。然而,大多数DeFi代币的状况甚至比BTC或ETH还要糟糕.
1900/1/1 0:00:00来源:智通财经网 智通财经APP注意到,随着比特币等加密货币价格回升,加密货币交易所CoinbaseGlobal(COIN.US)的股价周二涨超10%,截至周二美股收盘,涨12.24%.
1900/1/1 0:00:00半月前,风投“顶流”三箭资本因大量清算手中代币而陷入破产传闻。半月后,昔日的币圈“百亿基金”可能真的走到了终局.
1900/1/1 0:00:00在市场复苏的这一周,五种加密货币的涨幅高达70%,回升至超过1万亿美元。看涨时期是由比特币的反弹推动的,这让投资者在本周得到了一些缓解,此外导致整体市场下跌的事件有所缓解,例如Terra(Lun.
1900/1/1 0:00:00自去年11月初创下高峰之后,比特币、以太坊等加密货币在今年上半年又进入了新一轮下跌行情。其中,比特币刚跌下2万美元大关,创下近一年半以来最低价,以太币的价格也已较4月初跌去了2/3.
1900/1/1 0:00:00今年4月全国“打击整治养老专项行动”启动以来,司法机关加大了对养老犯罪的打击力度,我们也在不断揭露新型养老局:“投资理财”“以房养老”“保险代办”“文玩收藏”“养生保健”“黄昏恋”“关.
1900/1/1 0:00:00